|
2014; 2(1): |
Prävention, Diagnostik, Therapie
1Klinische Abteilung für Infektionen und Tropenmedizin, Universitätskliniklinik für Innere Medizin I, Medizinische Universität Wien;
2Infektiologie, Immunologie, Rheumatologie, Pneumologie; Universitätsklinik für Innere Medizin VI, Medizinische Universität Innsbruck;
3Österreichische Agentur für Gesundheit und Ernährungssicherheit (AGES), Wien;
4Institut für Hygiene, Mikrobiologie und Tropenmedizin, Krankenhaus der Elisabethinen Linz;
5Niedergelassener Arzt für Allgemeinmedizin, Hartberg;
6Institut für Hygiene, Mikrobiologie und Umweltmedizin, Medizinische Universität Graz;
7Zentrum für Krankenhaushygiene und Infektionskontrolle der SALK, Universitätsklinikum der PMU, Salzburg;
8Klinische Abteilung für Gastroenterologie und Hepatologie, Universitätsklinik für Innere Medizin, Medizinische Universität Graz;
9Krankenhaushygiene, Donauspital im SMZ Ost der Stadt Wien;
10Infektiologie, Universitätsklinik für Innere Medizin (UKIM), Medizinische Universität Graz;
114. Medizinische Abteilung mit Gastroenterologie und Hepatologie, Krankenanstalt Rudolfstiftung, Wien;
12Klinische Abteilung für Gastroenterologie und Hepatologie, Universitätsklinik für Innere Medizin III, Medizinische Universität Wien;
13Klinische Abteilung für Gastroenterologie und Hepatologie, Universitätsklinik für Innere Medizin, Medizinische Universität Graz;
14Abteilung Vertragspartner Medikamente, Hauptverband der österreichischen Sozialversicherungsträger, Wien;
15Klinische Abteilung für Gastroenterologie und Hepatologie, Universitätsklinik für Innere Medizin II, Medizinische Universität Innsbruck;
16Krankenhaushygiene, Krankenhaus Rudolfstiftung Wien;
Die steigende Zahl an Infektionen mit Clostridium difficile (CD) und die steigende Zahl an Therapieoptionen hat die Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin (ÖGIT) veranlasst, einen Konsensus zur Therapie der Clostridium-difficile-Infektion (CDI) zu initiieren.
1. Epidemiologie
Die CDI ist die häufigste Ursache einer nosokomialen Diarrhoe und betrifft ca. 1 % aller im Krankenhaus aufgenommenen Patienten. In ca. 20 % der Fälle wurde die Infektion ambulant erworben. Die Krankenhaus-assoziierte Mortalität liegt im Allgemeinen bei etwa 1 %, bei Ausbrüchen jedoch unter Umständen erheblich höher [1,2].
In einer europäischen Studie aus 34 Ländern wurde, bei erheblichen Schwankungen, eine mittlere Inzidenz der CDI von 4,1 pro 10.000 Patiententage erhoben. 65 Ribotypen von C. difficile wurden gefunden, wobei die Prävalenz des besonders virulenten Ribotyps 027 in dieser Arbeit bei 5 % lag. Bei den meisten Patienten bestand ein vordefiniertes Risikoprofil (höheres Lebensalter, Komorbiditäten, rezente Antibiotikatherapie). Im weiteren Verlauf starben 22 % der untersuchten Patienten, wobei in 40 % der Todesfälle (8,7 % aller Patienten) CD als Ursache anzusehen war [3].
Für Österreich wurden 7,5 CDI pro 10.000 Patiententage und 36 pro 10.000 Spitalsaufnahmen gefunden. 92 % der Fälle wurden als Gesundheitssystem-assoziiert eingestuft [3]. Tabelle 1 erläutert kurz die 2010 eingeführte Meldepflicht für CDI-Fälle in Österreich. Betrachtet man die Meldedaten für Österreich zwischen 2009 und 2012, so würde sich daraus ein dramatischer Anstieg der CDI-Fälle ergeben. Dieser ist jedoch mit größter Wahrscheinlichkeit durch ein verstärktes Bewusstsein für CDI und eine damit angestiegene Meldungszahl zu erklären. Zwar ist die Zahl der CDI-Fälle seit den neunziger Jahren des 20. Jahrhunderts wohl tatsächlich angestiegen; eine Auswertung der ICD-10-Diagnosen zeigt jedoch seit 2007 eher ein Plateau oder sogar einen leichten Abfall der gemeldeten Fälle. Für 2012 wurden für Österreich etwas unter 2.500 CDI-Fälle und 214 dadurch bedingte Todesfälle gemeldet.
|
Tabelle 1: Meldepflicht von CDI in Österreich
Quelle: [4] |
Die Annahme, dass vor allem jene Patienten im Krankenhaus eine CDI entwickeln, die zuvor bereits asymptomatische CD-Carrier waren, ist falsch – es konnte gezeigt werden, dass asymptomatische Träger toxigener CD-Stämme ein signifikant geringeres Risiko für die Entwicklung einer CDI aufweisen [5]. Die meisten Infektionen mit C. difficile finden also erst im Krankenhaus statt.
Weiteren Aufschluss über Häufigkeit und Ribotyp-Verteilung von CDI in Österreich gibt eine rezente österreichische Studie, an der neun Krankenhäuser in Wien und je eines aus jedem anderen Bundesland teilnahmen [6]. 171 Patienten nahmen teil, davon 69 % Frauen. Das mittlere Alter lag bei 76 Jahren; 74 % waren 65 Jahre oder älter. 89 % hatten eine primäre CDI-Episode, 11 % ein Rezidiv. Bei 3,5 % der Patienten bestand eine pseudomembranöse Kolitis, bei 0,6 % ein toxisches Megakolon und bei 1,8 % ein Ileus. 4,7 % benötigten einen Intensivaufenthalt, 1,2 % eine chirurgische Intervention. 73 % der Fälle waren Gesundheitssystem-assoziiert, 20 % ambulant akquiriert, bei 7 % war der Akquisitionsmodus nicht zu erheben.
Ein wesentliches Ergebnis dieser Studie bestand jedoch darin, dass C. difficile Ribotyp (RT) 027 (auch als NAP1-Stamm bezeichnet) der häufigste erhobene Stamm war (19,9 %), gefolgt von den Ribotypen 014 (15,8 %), 053 (10,5 %) und 078 (5,3 %). Allerdings wurde RT 027 nur in Wien, Niederösterreich und dem Burgendland gefunden. Es handelt sich hier um eine klassische, nosokomial bedingte Ausbruchssituation. Der gefundene RT 027 war zu 100 % gegen Moxifloxacin resistent. Die Studie zeigte auch, dass 85 % RT-027-Isolate Gesundheitssystem-assoziiert waren, jedoch nur 70 % der restlichen Isolate – ein klarer Hinweis darauf, dass zurzeit der RT-027-Klon in Ostösterreich in besonderem Ausmaß nosokomial übertragen wird [6]. Dennoch ist nicht zu leugnen, dass es einen gewissen Anteil von ambulant erworbenen CDI-Fällen gibt.
Eine andere österreichische Studie errechnete eine Gesamtzahl von im Krankenhaus akquirierten CDI-Fällen von knapp über 7.000 und gab darauf basierend eine Einschätzung von ca. 1.200 Todesfällen ab [7].
Es gibt auch gewisse Hinweise auf ein tierisches CD-Reservoir im Rahmen der Tierzucht, z. B. bei Schweinen [8]. Dies dürfte aber derzeit in Österreich eine untergeordnete Rolle spielen. In diesem Zusammenhang soll die Wichtigkeit von Surveillance-Systemen in Krankenhäusern betont werden.
2. Pathogenese und Krankheitsverlauf
Risikofaktoren für das Auftreten einer CDI sind Antibiotika, wobei in der Praxis nahezu alle Substanzklassen infrage kommen. Darüber hinaus können aber auch Chemotherapeutika wie Doxorubicin, Cisplatin, Cyclophosphamid, Fluorouracil oder Chlorambucil sowie auch Methotrexat eine CDI auslösen. Weitere Risikofaktoren sind Krankenhausaufenthalt, Alter über 50 Jahren, Gabe von Protonenpumpenhemmern (PPI) [9], nicht jedoch von H2-Blockern, gastrointestinale Endoskopien, nasogastrale bzw. PEG-Sonden [10]. Es konnte gezeigt werden, dass im Prinzip bereits eine einzige Dosis eines Antibiotikums (wie sie z. B. nicht selten prä- bzw. intraoperativ verabreicht wird) genügt, um eine CDI auszulösen [11].
Tabelle 2 zeigt das Risiko für die Entwicklung einer CDI in Abhängigkeit von der Antibiotikaklasse und der Dauer der Verabreichung. Es ist darauf hinzuweisen, dass einzelne Antibiotika(klassen), vor allem Tetrazykline und Cotrimoxazol, mit keinem erhöhten CDI-Risiko verbunden sind.
|
Tabelle 2: CDI-Risiko in Abhängigkeit von der Antibiotikaklasse und der Verabreichungsdauer
Quelle: [12] | |||||||||||||||||||||||||||||||||||
In-vitro-Studien zeigen eine unterschiedliche Beeinflussung des Wachstums von C. difficile durch unterschiedliche Antibiotika, die den Erreger nicht in ihrem Wirkspektrum haben [13].
C. difficile ist ein ubiquitär vorkommendes, grampositives, sporenbildendes, anaerobes Bakterium, das auf fäkooralem Weg verbreitet wird. Die Sporen dieses Erregers können im Krankenhaus monatelang überleben. Oral aufgenommen, proliferiert C. difficile dann, wenn die normale Kolonflora gestört ist (Risikofaktoren s. oben).
Für die Entstehung und den Schweregrad der CDI spielt nicht die Besiedelung des Kolons mit C. difficile per se, sondern vor allem die Toxinbildung (Toxin A und B) eine entscheidende Rolle [14,15]. Bestimmte besonders virulente Stämme von CD, wie der RT 027, produzieren zusätzlich zu Toxin A und B ein sogenanntes binäres Toxin und sind außerdem durch eine Deletion in einem Repressorgen der Toxinproduktion imstande, wesentlich höhere Mengen an Toxinen zu bilden als andere Stämme [16]. Epidemische Ausbrüche von CDI mit solchen Stämmen können, wie z. B. 2003 in Quebec, Kanada, zu hohen Letalitätsraten von bis zu 14 % (bei sehr alten Patienten) führen [17].
Die von CD verursachten Krankheitsbilder reichen von der asymptomatischen Infektion über Diarrhoe ohne Kolitis, Kolitis mit oder ohne Diarrhoe (mit diffusem Erythem und Entzündung) bis hin zu den schwersten CDI-Manifestationen: der pseudomembranösen Kolitis (etwa 3,5 % der Fälle [7]) und dem toxischen Megakolon.
Einer der für den Krankheitsverlauf nach Infektion mit CD bestimmenden Faktoren ist das Ausmaß der Bildung von IgG-Antikörpern gegen CD-Toxin A. Personen, die viele Antikörper bilden, haben eine wesentlich höhere Wahrscheinlichkeit, entweder asymptomatische Carrier zu werden oder einen milden Krankheitsverlauf zu entwickeln [5,14,18,19]. Abb. 1 zeigt ein Schema der CDI-Pathogenese.
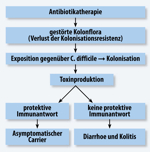
|
Abbildung 1: Pathogenese der CDI
Quelle: adaptiert nach [18] Click on the figure icon to see higher resolution |
Zur Verhinderung einer CDI bei Antibiotikatherapie wurden in etlichen Studien diverse Probiotika untersucht. Die Datenlage dazu ist recht heterogen, eine große Multicenterstudie bei älteren Patienten konnte zuletzt keine signifikante Reduktion der CDI bei Gabe eines Multispezies-Probiotikums zeigen [20]. Im Gegensatz dazu wurde in einer rezenten Metaanalyse, die 23 Studien mit mehr als 2.000 Patienten berücksichtigte, eine Reduktion der Clostridium-difficile-assoziierten Diarrhoe um ca. 60 % bei Patienten mit Antibiotikatherapie nachgewiesen [21].
3.1 Mikrobiologische Diagnostik
Eigentlich sollten nur dünne bzw. flüssige Stühle (Bristol-Stuhlformen-Skala 5–7 [22]) auf CD untersucht werden, was jedoch in der Praxis oft auf Schwierigkeiten stößt. Eine Stuhlprobe genügt in der Regel – bei begründetem klinischem Verdacht und negativem Erstbefund kann jedoch das Einschicken von zwei weiteren Stuhlproben gerechtfertigt sein. Die vorhandenen CD-Testsysteme lassen sich in drei Gruppen einteilen:
- Tests auf Produkte von CD (Glutamatdehydrogenase [GDH], Fettsäuren, Toxine A und B)
- Kulturelle Methoden zur Detektion toxinbildender CD-Stämme (sogenannte toxigene Kultur)
- Tests auf CD-Gene (PCR für 16S-DNA, Toxingene, GDH-Gene)
Als Referenzstandards gelten zwei Verfahren: einerseits der Zell-kultur-Zytotoxizitäts-Assay (CCA), andererseits die toxigene Kultur. Tabelle 3 stellt diese beiden Verfahren einander gegenüber.
|
Tabelle 3: Referenzverfahren in der CD-Diagnostik
Quelle: A. Grisold |
Beide Referenzverfahren haben den Nachteil, länger als 48 Stunden zu dauern. Sie wurden daher in der Praxis weitgehend verlassen, dienen jedoch in Studien weiterhin als Vergleichsstandard, um neue, schnellere Testverfahren zu evaluieren [23]. Solche Testverfahren sind
- Toxin-Enzym-Immuno-Assays (EIA),
- GDH-EIA und
- PCR
Zu den Toxin-EIA ist zu sagen, dass sie auf jeden Fall CD-Toxin B detektieren müssen, da auch Stämme, die kein Toxin A, wohl aber Toxin B exprimieren, pathogen sind.
GDH-EIA weisen alle Stämme von C. difficile nach, weiters auch verwandte Erreger wie C. sporogenes – mit GDH-EIA erfolgt somit ausschließlich ein unspezifischer Erreger-, aber kein Toxinnachweis.
PCR-Verfahren weisen die Gene für das jeweilige Toxin (TcdA bzw. TcdB) oder auch für Toxin-Regulationsproteine nach. Während EIA-Tests keineidealen
Sensitivitäten und Spezifitäten aufweisen [24], schneiden molekulare Verfahren, welche die Gensequenzen für Toxin A
In Anbetracht der Prävalenz von CDI und aufgrund der daraus resultierenden nicht idealen positiven und negativen Vorhersagewerte der zur Verfügung stehenden Verfahren sollte laut geltenden ESCMID-Empfehlungen in der CD-Diagnostik ein zweistufiges Verfahren angewandt werden [33]. Ein einheitlicher Goldstandard fehlt allerdings. Der erste durchgeführte Test sollte eine hohe Sensitivität (d. h. einen hohen negativen Vorhersagewert) aufweisen, um eine CDI mit möglichst großer Wahrscheinlichkeit ausschließen zu können [23]. Dies kann laut ESCMID-Empfehlungen ein EIA auf GDH oder die Toxine A und B oder eine Realtime-PCR auf TcdB sein [33]. Ist dieser Test negativ, so kann wegen des hohen negativen Vorhersagewerts eine CDI ausgeschlossen werden. Ist er positiv, so wird – je nachdem, welcher Ersttest gemacht wurde – zur Bestätigung ein EIA auf GDH, ein EIA auf Toxin A und B, eine Realtime-PCR auf TcdB oder ein Zytotoxizitätstest durchgeführt [24].
Für den Fall, dass – z. B. mittels GDH-EIA – CD im Stuhl nachgewiesen wird, jedoch keine CD-Toxine detektierbar sind, sollte bei dringendem klinischem Verdacht eine CDI-Therapie erfolgen, da auch bei einem negativen Vorhersagewert von z. B. 97&haitrsp;% immerhin drei von 100 symptomatischen Patienten falsch negative CD-Befunde haben.
Wesentlich ist jedoch, dass der Nachweis eines toxinbildenden CD-Stammes im Stuhl bei fehlender klinischer Symptomatik keine Indikation für eine CD-Therapie bzw. für das Absetzen einer laufenden Antibiotikatherapie mit anderer Indikation bedeutet.
Mikrobiologische Nachuntersuchungen, um den Therapieerfolg zu kontrollieren, sind nicht indiziert. Auch als Parameter für die Aufhebung einer Patientenisolierung ist eine mikrobiologische Stuhluntersuchung nicht geeignet.
Ein „automatisches Bestimmen“ von CD im Stuhl bei „allgemein gehaltenen“ Zuweisungen ist in den mikrobiologischen Labors nicht üblich bzw. im Krankenhaus schon aus verrechnungstechnischen Gründen nicht möglich. Eine Untersuchung auf C. difficile muss daher dezidiert auf dem Anforderungsschein angefordert werden. Ab einer Liegedauer von fünf bis sechs Tagen ist bei Neuauftreten einer Diarrhoe die Wahrscheinlichkeit für eine CDI sehr hoch – daher sollte in solchen Fällen (sofern kein Ausbruch vorliegt) primär auf CD untersucht werden.
3.2 Klinische Diagnostik
Laut WHO ist Diarrhoe definiert als verminderte Stuhlkonsistenz durch vermehrte Flüssigkeit im Stuhl beziehungsweise durch erhöhte Stuhlfrequenz
(≥ 3 Stuhlgänge pro Tag) und erhöhtes Stuhlgewicht (≥ 200
Tabelle 4 stellt die Charakteristika von drei unterschiedlichen Formen der Diarrhoe bei Antibiotikatherapie gegenüber: der CDI, der funktionellen, durch Antibiotika bedingten Diarrhoe und der seltenen, durch Klebsiella oxytoca bedingten Antibiotika-assoziierten hämorrhagischen Kolitis (AAHC).
|
Tabelle 4: Differentialdiagnose der CDI
Quelle: adaptiert nach [28] |
Eine rein klinische Unterscheidung einer CDI von anderen Formen der Diarrhoe ist ohne Zusatzuntersuchungen kaum möglich. So hat sich etwa die immer wieder geäußerte Behauptung, CDI-Stuhl sei anhand des Geruchs zu erkennen, in einer Studie als haltlos erwiesen [29].
Von therapeutischer Relevanz ist die Unterscheidung zwischen schweren und nicht schweren Verlaufsformen der CDI. Allerdings herrscht über die dafür heranzuziehenden Kriterien international keine völlige Einigkeit [17,30]. So wurden für manche Studien sogar eigene Definitionen der schweren CDI erstellt [31]. Dies gilt übrigens auch für die Zulassungsstudien mit Fidaxomicin [32]. Tabelle 5 fasst mögliche Parameter zusammen (s. aber Punkt 4.1).
|
Tabelle 5: Mögliche Kriterien für eine schwere CDI
Quelle: adaptiert nach [28] | ||||||||||||||||||||||||||||||
An Zusatzuntersuchungen (sofern überhaupt indiziert) ist an erster Stelle die Kolonoskopie zu nennen, die bereits morphologisch Hinweise auf unterschiedliche Ätiologien gibt und z. B. die direkte Diagnose einer pseudomembranösen Kolitis erlaubt (s. auch Tabelle 4). Bildgebende Verfahren wie z. B. die Computertomographie kommen vor allem bei Verdacht auf toxisches Megakolon, d.&ha5rs*;h. bei schwerer CDI vor möglicher Operation, zum Einsatz. Schließlich sei noch darauf verwiesen, dass es vereinzelt auch schwere Verlaufsformen einer CDI ohne Diarrhoe gibt. Bei intensivpflichtigen Patienten mit Sepsis unklarer Genese sollte die CDI daher auch bei Fehlen einer Diarrhoe in die Differenzialdiagnose einbezogen werden [2].
4.1.1 Erstlinientherapie
Zunächst ist eine Unterscheidung zwischen schwerer und nicht schwerer CDI zu treffen. Für die Praxis erscheint es sinnvoll, die Kriterien aus dem Update der ESCMID-Therapieleitlinien 2014 zu übernehmen [33]. Diese lauten:
„Eine schwere oder lebensbedrohliche CDI ist definiert als CDI-Episode mit einem oder mehreren spezifischen Zeichen und Symptomen von schwerer Kolitis oder einem komplizierten Krankheitsverlauf mit signifikanten systemischen Toxinwirkungen und Schock, der zu einer Intensivtherapie, einer Kolektomie oder zum Tod führt.“
Hinweiszeichen auf einen schweren Krankheitsverlauf (und damit prognostisch ungünstige Parameter) können die folgenden Laborwerte sein (sofern sie nicht anderweitig erklärbar sind):
- Leukozytose (
> 15 x 109 / l ) - Reduziertes Serumalbumin (
< 30 g / l ) - Anstieg des Serumkreatinins (
≥ 1,5 mg / dl oder ≥ 1,5 x prämorbider Ausgangswert)
Diese Laborwerte sollten am selben Tag wie die Stuhluntersuchung bestimmt werden. Das Lebensalter
|
Tabelle 6: Frei- und Handelsnamen der (therapeutisch) erwähnten Antibiotika
Quelle: Austria Codex Fachinformation, Stand Dezember 2013 |
Eine besondere Gruppe stellen jene Patienten dar, bei denen ein erhöhtes Risiko für ein CDI-Rezidiv besteht. Prognostische Marker für ein erhöhtes Rezidivrisiko,
die nach Meinung der Autoren ein anderes Vorgehen als oben beschrieben rechtfertigen, sind die Fortsetzung einer systemisch wirksamen Antibiotikatherapie nach
CDI-Diagnose bzw. -behandlung und CDI in der Anamnese [33]. Im Gegensatz dazu erscheinen die anderen, ebenfalls in der ESCMID-Leitlinie 2014
genannten prognostischen Faktoren für ein erhöhtes Rezidivrisiko, nämlich das Alter über 65 Jahren und die Einnahme von Protonenpumpenhemmern (PPI), von geringerer
Bedeutung zu sein [33]. Dennoch sollte bei jedem CDI-Patienten, der einen PPI erhält, die Indikation für diesen kritisch überprüft werden.
Für diese Patientengruppe kommt entweder Vancomycin p.o.
Bei schwerer CDI ist Vancomycin p.o.
Eine Kombinationstherapie Vancomycin / Metronidazol bringt bei schwerer CDI bezüglich der Endpunkte Heilungsrate, mediane Zeit bis zur Heilung, Relapserate und Auftreten weiterer Komplikationen keinen Vorteil gegenüber einer Vancomycin-Monotherapie [34].
Wenn eine orale Therapie nicht möglich ist, kann bei nicht schwerer CDI Metronidazol durch 10–14 Tage i.v. in einer Dosis von 3 x 500 mg gegeben werden.
Bei schwerer CDI kann zusätzlich zur Metronidazol-Therapie Vancomycin als intrakolonischer Einlauf (
Eine Therapie einer CD-Infektion mit Rifaximin kann aufgrund der schwachen Datenlage nicht empfohlen werden.
4.1.2 Rezidivprophylaxe
Bis zu ca.
Ein erstes Rezidiv kann mit derselben Substanz therapiert werden, die bereits bei der Primärtherapie verwendet wurde. Ab dem zweiten Rezidiv wird aufgrund des
Nebenwirkungsspektrums (periphere Neuropathie, kumulative Neurotoxizität) von der Verwendung von Metronidazol abgeraten. Eine Therapiemöglichkeit ist die
ausschleichende Gabe („tapered pulse“) von Vancomycin (Schema s. Tabelle 7) [37].
Tabelle 7: Medikamentöse Therapieempfehlungen für CDI
Quelle: Autoren
Eine prophylaktische Rezidivtherapie bei Patienten, die eine CDI hatten und neuerlich eine antimikrobielle Therapie aufgrund einer anderen Infektion benötigen,
ist nicht indiziert. Probiotika werden auch zur Verhinderung weiterer Rezidive bei CDI eingesetzt. Die Gabe von Saccharomyces boulardii nach einer Therpie mit
Vancomycin (aber nicht mit Metronidazol) konnte das Risiko für ein neuerliches Rezidiv reduzieren [38].
Für andere probiotische Präparate und Synbiotika existieren Fallberichte zur erfolgreichen Behandlung einer rezidivierenden CDI.
Tabelle 7 fasst die medikamentösen Therapieempfehlungen zusammen.
4.2 Fäkale Mikrobiota-Transplantation (FMT)
Unter FMT versteht man die Übertragung einer fäkalen Suspension eines gesunden Spenders in den Gastrointestinaltrakt eines Erkrankten. Ziel ist die
Wiederherstellung einer normalen Homöostase des Mikrobioms. Kleinere Studien bzw. Fallserien zur FMT bei CDI zeigten Erfolgsraten zwischen 83 und 100 %
[41].
Eine Studie mit 70 Patienten mit CDI-Rezidiven, bei denen eine FMT per Kolonoskopie ins Zoekum erfolgte, zeigten nach zwölf Wochen eine Heilungsrate von
100 % in der Gruppe ohne RT 027 (n = 34) und von 89 % bei RT 027 (n = 36). Nach einem Jahr
zeigten vier dieser Patienten nach neuerlicher Antibiotikatherapie ein weiteres Rezidiv, wobei zwei nochmals mit FMT und zwei mit Antibiotika behandelt wurden
[42]. Langzeitergebnisse aus einer multizentrischen Studie mit 73 Patienten mit Rezidiv-CDI, die eine kolonoskopische FMT erhielten,
zeigten eine mittlere Heilungsrate von 91 % nach 17 Monaten, wobei es bei 74 % der Patienten nach maximal drei Tagen, bei 82 % nach
maximal fünf Tagen zu einem Sistieren der Diarrhoe kam (und bei weiteren 17 % zu einer Besserung) [43]. Ein systematischer Review
von zwölf Studien mit insgesamt 182 Patienten mit rezidivierender CDI zeigte bei kolonoskopischer FMT eine Heilungsrate von 93 % und bei nasogastraler
FMT eine Heilungsrate von 85 % [44]. Allerdings war die nasogastrale Gruppe im Durchschnitt älter, und die kolonoskopisch
transplantierten Patienten erhielten höhere Stuhlvolumina und eine Lavage als Vorbereitung. Eine Studie, in der bei CDI-Rezidiven die Gabe von Vancomycin
(4 x 500 mg) allein, Vancomycin mit Darmlavage und Vancomycin in Kombination mit FMT verglichen wurde, musste nach 43 Patienten aufgrund einer
Interimsanalyse abgebrochen werden, da sich mittels Vancomycin plus FMT eine Heilungsrate von bis zu 94 % erzielen ließ, mittels Vancomycin allein nur
eine Heilungsrate von 31 % [45]. Die FMT ist nicht gänzlich ohne Nebenwirkungen: Vor allem am Tag der Transplantation kann es zu
Aufstoßen, Übelkeit, Bauchkrämpfen und auch Fieber kommen. Es konnte gezeigt werden, dass die Diversität des Mikrobioms, die bei CDI-Patienten stark reduziert
ist, durch die FMT wieder auf das Niveau des gesunden Spenders angehoben werden kann [45]. Tabelle 8 zeigt
Ausschlusskriterien für Stuhlspender. Der endgültige Stellenwert der FMT bei CDI ist noch nicht geklärt. Derzeit sollte die Indikation daher – nach
mehrfachen CDI-Rezidiven trotz adäquater antibiotischer Therapie – individuell gestellt und die Therapie in einem spezialisierten Zentrum durchgeführt
werden.
Tabelle 8: Ausschlusskriterien für Stuhlspender
Quelle: [46]
5. Hygienemaßnahmen
Es besteht kein Zweifel daran, dass ein Großteil der CDI durch Kontamination von patientennahen Oberflächen mit CD-Sporen entstehen
[47,48,49,50].
Der Unterschied zu anderen nosokomialen Erregern besteht darin, dass der Stellenwert der Händedesinfektion bei CD geringer ist, weil die verwendeten
Desinfektionslösungen auf alkoholischer Basis nicht sporozid wirken. Umso größer ist der Stellenwert des Händewaschens.
Eine Studie mit 30 CDI-Patienten zeigte, dass die Akquisition von CD-Sporen auf behandschuhten Händen mit gleicher Wahrscheinlichkeit von der Haut des
Patienten wie von typischen Umgebungsflächen (Nachtkästchen, Telefon, Bettgeländer etc.) erfolgt [51]. Basisreinigungsmaßnahmen
stellen eine hygienische Grundnotwendigkeit dar und dürfen nicht eingespart werden. Es gibt Beispiele aus anderen Ländern, wo sich die CDI-Rate mittels
Investitionen in zusätzliche Reinigungskräfte und eine Schulung des Personals signifikant senken ließ.
Eine der wichtigsten hygienischen Maßnahmen ist die präemptive Isolation des Patienten schon bei CDI-Verdacht - es sollte nicht auf den Befund gewartet
werden, da zum Zeitpunkt des Eintreffens der Befunde schon längst eine Sporenverbreitung stattgefunden hat. Dies gilt nicht nur bei Ausbrüchen, sondern in
jedem symptomatischen Einzelfall [52,53]. Als Mindeststandard für die Isolation ist zu fordern, dass dem
CDI-Patienten ein eigenes WC zur Verfügung steht. Die Isolation sollte zumindest bis 48 h nach Sistieren der Diarrhoe aufrecht bleiben. Weiters sollten
häufig berührte Oberflächen täglich desinfiziert werden [52,54]. Zur sporoziden chemischen Wischdesinfektion
können chlorbasierte Verfahren (in Österreich allerdings nicht üblich), Aldehyde, Sauerstoffabspalter oder ev. Peressigsäure verwendet werden. Daneben
kommen als sporozide Maßnahmen die Desinfektion der Raumluft (z. B. Raumdesinfektion mit UV-Bestrahlung oder Vaporisation von H2O2)
und sogenannte selbstdesinfizierende Oberflächen (
In einer weiteren Arbeit konnte gezeigt werden, dass mit einem Konzept der regelmäßigen, täglichen Flächendesinfektion die CD-Transmission auch und gerade
auf Stationen mit hoher endemischer CD-Belastung erfolgreich reduziert werden kann [56].
Erwähnenswert ist auch, dass eine Auslastung der Bettenkapazität über 80 % ein signifikanter Risikofaktor für CDI ist, da durch den engen räumlichen
Kontakt sowohl von Patienten untereinander als auch von Patienten und Personal sowie durch die hohe Arbeitsbelastung des Personals die Übertragung begünstigt
wird [57].
Bei der Entlassung aus dem stationären Bereich eines Akut-krankenhauses, z. B. in ein Pflegeheim, sollte mitgeteilt werden, ob es sich um eine
symptomatische Situation (in den vergangenen 48 h ist mindestens einmal ungeformter Stuhlgang aufgetreten) oder um einen nicht symptomatischen Zustand
nach Clostridium-difficile-Erkrankung handelt.
6. Prävention – Antibiotic Stewardship
Antibiotika sind als Risikofaktor für CDI gut dokumentiert, ebenso wie auch deren häufig inadäquate und falsch indizierte Verwendung. Eine Untersuchung an
246 Patienten mit CDI zeigte, dass 77 % der Probanden mindestens eine unnötige Antibiotikadosis und 26 % ausschließlich unnötige Antibiotika
erhalten hatten [58]. Interventionen zum gezielteren Einsatz von Antibiotika durch verbesserte Infektionsdiagnostik [59]
sowie Restriktion von Hochrisiko-Antibiotika haben, speziell auch in Ausbruchssituationen, zur Senkung der CDI-Inzidenz geführt
[60,61,62]. Bei einem Ausbruch mit RT 027 in Kanada konnte die Situation trotz konsequenter
Hygienemaßnahmen erst nach Einschränkung der Verwendung von Hochrisiko-Antibiotika beherrscht werden [63]. Antibiotic-Stewardship-Interventionen
können somit einen wichtigen Beitrag zur Kontrolle von CDI leisten.
7. Ökonomische Aspekte
Tabelle 9 fasst die Materialkosten für Hygienemaßnahmen bei CDI zusammen.
Tabelle 9: Beispielhafte Materialkosten für Hygienemaßnahmen bei CDI
Quelle: [64]
Tabelle 10 zeigt die Therapiekosten für bei CDI infrage kommende Antibiotika für eine zehn Tage dauernde Therapie auf Basis des österreichischen
Kassenverkaufspreises (KVP). Die im Krankenhaus anfallenden Kosten können von den hier angegebenen Kassenverkaufspreisen allerdings erheblich
abweichen; einerseits wegen unterschiedlicher Einkaufspreise, andererseits auch, weil z. B. Vancomycin-Kapseln in manchen Spitalsapotheken erheblich
billiger hergestellt werden können als die fertigen, im Handel erhältlichen Kapseln.
Tabelle 10: Therapiekosten (nur Antibiotika) bei CDI im niedergelassenen Bereich
Quelle: [64]
Diese Zahlen verdeutlichen die erheblichen Unterschiede in den Therapiekosten zwischen den verschiedenen Wirkstoffen. Auch die FMT ist mit Kosten verbunden,
wobei einerseits das Spenderscreening (siehe Kapitel 4.2) und andererseits die Aufbereitung und Applikation des Spenderstuhls zu
nennen sind. Konkrete Zahlen dazu lagen der Arbeitsgruppe bei Erstellung des Konsensuspapiers allerdings nicht vor.
Eine Analyse der Gesamtkosten einer CDI aus der Universitätsklinik Greifswald, Deutschland, ergab Kosten von 5.262,96 € pro CDI-Fall. Davon wurden allein
94,4 % durch die beiden Faktoren „erhöhte Verweildauer im Krankenhaus“ und „Bettensperre während Isolation“ verursacht,
Hygienemaßnahmen machten weitere 4,8 % aus. Die Kosten für Arzneimittel (0,43 %) und Labor (0,33 %) waren demgegenüber verschwindend
gering [64]. Eine Abschätzung der gesamten volkswirtschaftlichen Kosten der CDI in Österreich ist aufgrund etlicher Einflussgrößen
schwierig. Je nach unterschiedlich angenommenen Parametern wie z. B. der geschätzten Anzahl der CDI-Episoden, der möglichen Medikamenten- und der
Spitalsausgaben kann man spekulieren, dass die jährlichen Kosten – mit einer enormen Schwankungsbreite und einem großen Unsicherheitsfaktor behaftet
– in einer Größenordnung von rund 4 bis 40 Millionen Euro pro Jahr anzusiedeln sein könnten (R. Sauermann, eigene Berechnungen).
Interessenkonflikte
Dieses Projekt wurde durch die Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin (zu 93 %) sowie die Österreichische
Agentur für Gesundheit und Ernährungssicherheit (zu 7 %) ohne jegliches externes Sponsoring durch die Pharmaindustrie finanziert. Alle Autoren
haben unentgeltlich an diesem Projekt mitgearbeitet.
Literatur
Indikation
Erste Wahl
Zweite Wahl
Nicht schwere CDI
Metronidazol p.o.
durch 10 d
Vancomycin p.o.
oder Fidaxomicin p.o.
jeweils durch 10 d
Patienten mit nicht schwerer CDI und erhöhtem Rezidivrisiko
Vancomycin p.o.
oder Teicoplanin p.o.
oder Fidaxomicin p.o.
jeweils durch 10 d
–
Schwere CDI
Vancomycin p.o.
–
Wenn orale Therapie nicht möglich
Nicht schwere CDI
Metronidazol i.v.
durch 10–14 d
(Dosiserhöhung auf 2 g erwägen)
–
Schwere CDI
Metronidazol wie oben
zusätzlich Vancomycin als Einlauf
(
–
Bei CDI-Rezidiv
Erstrezidiv
Metronidazol
Vancomycin
Teicoplanin
Fidaxomicin
(Ersttherapie kann wiederholt werden)
–
Zweitrezidiv
„tapered-pulsed“ Vancomycin
(Vancomycin ausschleichend p.o.)
[40]
Fidaxomicin
Infektionsrisiko
Gastrointestinale Komorbiditäten
Anderes
Material
Preis1 pro Tag
Einheit
Tag
Fall2
Kittel Personal
1,56
9,35
73,32
Kittel Besucher
0,29
0,57
4,47
Handschuhe
3,33
1,11
8,70
Desinfektionsmittel
0,87
1,74
13,65
Desinfektionsmittel Hände
0,73
0,36
2,82
Summen
13,13
102,96
1 Alle Preise in Euro
2 Für die Berechnung der Fallkosten wurde eine durchschnittliche Verweildauer in Isolation von 7,842 Tagen zugrunde gelegt.
Wirkstoff
Dosierung
Kosten für 10 Tage Therapie
Metronidazol
18
51
Vancomycin (Enterocaps)
607
Teicoplanin
932
Fidaxomicin
1.590
Anmerkung: zusätzliche Kosten durch Verwurf bei Packungsanbruch sind nicht berücksichtigt. Bei Verfügbarkeit mehrerer
Arzneispezialitäten / Produkte zu einem Wirkstoff werden primär kostengünstigere Varianten angezeigt.
Angaben gerundet.




















































































































published online:
17 October 2014
english abstract