|
2017; 5 (1): |
Nonresponder und Durchbruchinfektionen unter antimykotischer Medikation
1Sektion für Hygiene und Medizinische Mikrobiologie, Departement für Hygiene, Mikrobiologie und Public Health, Medizinische Universität Innsbruck; 2Klinische Abteilung für Infektionen und Tropenmedizin, Universitätsklinik für Innere Medizin I, Medizinische Universität Wien; 33. Medizinische Klinik, Medizinische Fakultät Mannheim der Universität Heidelberg, Mannheim; 4Klinik für Kinder- und Jugendmedizin – Pädiatrische Hämatologie und Onkologie, Universitätsklinikum Münster; 5Klinische Infektiologie / AMS, Klinikum Nürnberg Nord, Nürnberg; 6Sektion Infektiologie und Tropenmedizin, Universitätsklinik für Innere Medizin, Medizinische Universität Graz; 7Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie, Hans-Knöll-Institut, Jena; 8Klinik für Hämatologie, Onkologie und Palliativmedizin, Klinikum Ernst von Bergmann, Akademisches Lehrkrankenhaus der Charité, Potsdam; 9Medizinische Klinik und Poliklinik II / Infektiologie, Universitätsklinikum Würzburg; 10Anästhesiologische Klinik, Universität Heidelberg; 11Klinische Abteilung für Klinische Mikrobiologie, Klinisches Institut für Hygiene und Medizinische Mikrobiologie, Medizinische Universität Wien
Invasive Pilzinfektionen haben in den letzten Jahren bei hospitalisierten Patienten zugenommen. Dies ist vor
allem auf die längere Überlebenszeit und die zunehmende Anzahl immungeschwächter multimorbider
Menschen zurückzuführen. Die häufigsten fungalen Pathogene in Europa sind Aspergillus-
und Candida-Spezies. In zunehmendem Maße werden aber auch andere Pilze, wie
Derzeit fehlen klare und einheitliche Definitionen eines Therapieversagens für den klinischen Alltag. In Studien werden die Begriffe „Nonresponder“ und „Durchbruchinfektion“ unterschiedlich definiert, die Bewertung ergibt sich jedoch meist aus dem Vorliegen von Krankheitssymptomen und einem Erregernachweis (siehe Tabelle 1). Der Zeitpunkt der Beurteilung eines Therapieversagens variiert hierbei am meisten [6].
Das vorliegende konsensuelle Experten-Statement versucht, die zugrunde liegenden Faktoren und Ursachen, diagnostische und therapeutische Maßnahmen sowie mögliche Definitionen zum Therapieversagen („Nonresponder“ und „Durchbruchinfektion“) zusammenzufassen. Es soll ein praktischer Leitfaden für den klinischen Alltag sein.
|
Tabelle 1: Definitonen
Quelle: [6] | ||||||||||||||||
1. Definitionen
Stringente und allgemein akzeptierte Definitionen der Begriffe „Nonresponder“ sowie „Durchbruchinfektion“ bei invasiven Pilzinfektionen („Invasive Fungal Infections“ – IFI) fehlen.
Nonresponse oder Nonresponder und Therapieversager
Es lässt sich argumentieren, dass ein Nichtansprechen sowohl einer „stable disease“ als auch
einer Progression entsprechen könnte. Segal hat 2009 für invasive Aspergillosen (IA) die „stable
disease“ definiert als „Überleben ohne oder nur mit geringer Verbesserung der zugehörigen
Symptome und Zeichen der Erkrankung, plus radiologische Stabilisierung; letztere ist definiert als
Progression definiert er als „Verschlechterung klinischer Symptome oder Krankheitszeichen, plus neue Krankheitsherde oder radiologische Verschlechterung präexistenter Läsionen, oder persistierende Isolierbarkeit von Schimmelpilzen aus infizierten Lokalisationen“ [7].
Diese Definitionen wurden allerdings für den Gebrauch in klinischen Studien erstellt. Weiters ist zu beachten, dass diese Definitionen auch eine minimale Beobachtungszeit von sechs Wochen (und als sekundären Endpunkt eine weitere Evaluierung nach zwölf Wochen) beinhalten [7].
Bei der radiologischen Diagnostik von IA bei neutropenischen Patienten ist als Caveat anzuführen, dass der CT-Befund im Zuge der Neutrophilen-Rekonstitution zunächst progredient und erst nach einigen Tagen regredient werden kann [8]. In anderen Studien gelten zum Teil auch andere Kriterien [5].
Als Indikation für eine Salvage-Therapie wurde in Phase-II-Studien Nichtansprechen über mindestens sieben Tage oder Unverträglichkeit einer konventionellen Therapie definiert [9, 10].
Kriterien für ein Therapieversagen bei invasiver Candidiasis und Fadenpilzinfektion finden sich in Tabelle 1.
Bei einer Durchbruchinfektion kann ein Pilznachweis unter einer antimykotischen Prophylaxe, empirischen, präemptiven oder gezielten antimykotischen Therapie erfolgen. Für Durchbruchinfektionen sowie Therapieversager kann es eine Reihe von Gründen geben; neben der Entwicklung einer Resistenz gegen Antimykotika können zu niedrige Wirkspiegel, das Nichterreichen eines klinisch relevanten Kompartiments oder eine zu kurze Therapiedauer verantwortlich sein. Es kann sich aber auch um ein Compliance-Problem handeln. Weiters könnte eine Pilzinfektion schon vor Beginn der antimykotischen Intervention bestanden haben, oder die Diagnose ist falsch bzw. es wird mit dem ungeeigneten Medikament behandelt. Schließlich können Koinfektionen mit anderen Erregern eine Rolle spielen. In verschiedenen Studien findet sich eine Reihe unterschiedlicher Definitionen für eine Durchbruchinfektion [11, 12, 13, 14, 15, 16, 17].
Therapieversagen und Durchbruchinfektion können als ein anhaltend unveränderter Infektionsstatus, als ein Fortschreiten der invasiven Mykose oder als Tod des Patienten definiert werden. Der Verdacht auf ein Therapieversagen liegt vor, wenn ein persistierender Pilznachweis und / oder fehlende klinische Verbesserung und / oder gar eine Verschlechterung der Symptome besteht [7, 8, 18, 19, 20, 21, 22, 23, 24], siehe auch Tabelle 1.
Für den klinischen Alltag kann am Beispiel der IA ein Therapieversagen (Nonresponder und Durchbruchinfektion) wie folgt interpretiert werden:
- Eine refraktäre IA ist definiert als Krankheitsprogression und sollte von stabiler Erkrankung differenziert werden [7].
- Das Ansprechen sollte als zusammengesetztes Outcome aus klinischen, radiologischen und mykologischen Kriterien beurteilt werden.
- Zumeist kann zwei Wochen nach Therapiebeginn beurteilt werden, ob ein Therapieversagen besteht:
- Patienten mit radiologischem Nichtansprechen [25] und per-sistierend hohem Galactomannan (GM) im Serum haben eine hohe Versagenswahrscheinlichkeit.
- Andererseits könnten Patienten mit radiologischem / klinischem Versagen ein Immunrekonstitutionssyndrom haben.
- Die Beurteilung des Therapieansprechens bei GM-negativer Pilzinfektion kann schwieriger sein.
- Eine Durchbruchinfektion (IA) ist definiert als Infektion, die während oder kurz nach einer
antimykotischen Therapie mit Anti-Aspergillus-Aktivität auftritt, unabhängig von der
Art dieser Therapie (prophylaktisch, empirisch, präemptiv oder Kultur-
+/− Histologie-basiert). Die minimale Dauer der Therapie vor Auftreten der IA sollte – abhängig von der Pharmakokinetik des verwendeten Medikaments – zumindest eine Woche betragen, damit eine Infektion als Durchbruchinfektion bezeichnet werden kann. Der zeitliche Abstand zwischen Beendigung der Therapie und Auftreten der IA kann bis zu einer Woche oder auch mehr betragen, damit die IA noch als Durchbruchinfektion bezeichnet werden kann.
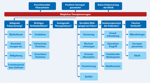
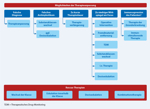
Abbildungen 1a und 1b geben einen Algorithmus bei Verdacht auf Therapieversagen:
|
Abbildung 1a: Mögliche zugrunde liegende Faktoren bei Therapieversagen
Quelle: [6] Click on the figure icon to see higher resolution |
|
Abbildung 1b: Möglichkeiten der Therapieanpassung
Quelle: [6] Click on the figure icon to see higher resolution |
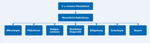
- Ist die aktuelle Diagnose einer Pilzinfektion noch korrekt? Bei Unsicherheit soll eine intensive Diagnostik durchgeführt werden. Die Abbildung 2 zeigt wichtige diagnostische Maßnahmen zum Nachweis von invasiven Pilzerkrankungen.
- Wurde das richtige Antimykotikum gewählt? Zu beachten ist die Gewebegängigkeit einer Substanz und die Frage, ob Resistenzen (intrinsische oder erworbene Resistenz) vorliegen. Liegt eine Schimmel- oder Hefepilzinfektion vor? Ein therapeutisches Drug-Monitoring ist vor allem für Triazole von Bedeutung, worauf auch die rezente ECIL-6-Konferenz hinwies [26].
- Ist die Therapiedauer adäquat? Internationale Guidelines empfehlen, bei Vorliegen einer invasiven Candida-Infektion eine Therapiedauer von mindestens 14 Tagen nach der ersten negativen Blutkultur einzuhalten. Bei invasiven Schimmelpilzinfektionen wird ein minimaler Zeitraum von sechs Wochen angegeben.
- Wie sind die Wirkspiegel des Antimykotikums am Infektionsort? Ist die Dosierung adäquat, kommt es zu Medikamenteninteraktionen oder ist die enterale Absorption unzureichend?
- Besteht beim Patienten eine anhaltende Immunsuppression? Schreitet die Grundkrankheit fort? Das Vorliegen einer Immunschwäche kann ein wichtiger Grund für ein Therapieversagen sein.
- Besteht ein falscher Verdacht auf ein Therapieversagen? Mykosen verlaufen unspezifisch, vorliegende Komorbiditäten und Koinfektionen können zu einem falschen Verdacht führen.
Sollten alle oben angeführten Gründe ausgeschlossen oder alle Maßnahmen ausgeschöpft worden sein, empfiehlt es sich, erneut diagnostische Maßnahmen durchzuführen und die primäre Therapie umzustellen.
|
Abbildung 2: Wichtige allgemeine diagnostische Maßnahmen zum Nachweis
invasiver Pilzinfektionen bei Patienten mit hohem Erkrankungsrisiko
Quelle: [27] Click on the figure icon to see higher resolution |
2. Häufigkeit von Nonresponse: Real-Life-Daten
Die klinische Bedeutung des Nichtansprechens zeigt sich in der Zusammenschau verschiedener Studien, in denen
Posaconazol, Voriconazol, Caspofungin oder Micafungin in unterschiedlichen Patientenpopulationen verwendet
wurden und in denen die Gesamtansprechraten zwischen
Eine Kohortenstudie aus Köln untersuchte die Inzidenz von mykotischen Durchbruchinfektionen (bIFI) bei 250 Patienten mit akuter myeloischer Leukämie (AML) und 409 Patienten nach allogener hämatopoetischer Stammzelltransplantation (HSCT); alle diese Patienten erhielten eine antimykotische Prophylaxe mit Posaconazol, Itraconazol oder Micafungin [15].
Bei den AML-Patienten fanden sich in
In einer kürzlich publizierten, prospektiven deutschen Multicenter-Studie („SEPIA“) waren
fungale Durchbruchinfektionen (bIFI) bei 97 / 3.067 Patienten mit akuten Leukämien
(
Bei
3.1 Hämatologie
Die bei bIFI in der Hämatoonkologie identifizierten fungalen Pathogene sind vielfältig und umfassen überwiegend Candida- und Aspergillus-Spezies (die nicht selten in vitro suszeptibel für das aktuell eingesetzte Antimykotikum sind) sowie Mucorales [33] und andere fungale Pathogene [34].
Zu fordern ist eine rasche und umfassende klinische Abklärung sowie die Kultur- und Empfindlichkeitsdiagnostik
(ggf. einschließlich molekularer Charakterisierung) aus relevanten klinischen Materialien einschließlich der
mikroskopischen Diagnostik, die bildgebende Diagnostik (CT, Sonographie), Biomarker-Diagnostik (wie
Dabei besonders zu berücksichtigen sind die korrekten Definitionen (Nonresponder vs. bIFI), der klinische Verlauf, die allgemeinen sowie auch die lokalen epidemiologischen Daten (im Hinblick auf seltenere fungale Pathogene) und die pharmakologischen Parameter der verwendeten Medikamente (therapeutisches Drug-Monitoring, Compliance, Resorption, Interaktionen etc.).
Insbesondere im Hinblick auf Hefepilzinfektionen ist eine Fokusdiagnostik unerlässlich (hepatolienale Candidiasis, Biofilminfektionen etc.).
IFI mit mehr als einer Pilzart sind möglich, wie
3.2 Intensivmedizin
Daten aus den USA zeigten bei mehr als einer halben Million ICU-Patienten eine Candidämie-Inzidenz von
3,9 / 1.000 Aufnahmen und eine 28-Tages-Gesamtsterblichkeit von
Auf deutschen ICU sind Candida-Spezies, nach Staphylokokken und Enterokokken, die dritthäufigsten
Erreger von nosokomialen Blutstrominfektionen, wobei Non-albicans-Spezies mit knapp
Wie in Abbildung 1a dargestellt, besteht ein Verdacht auf Therapieversagen unter
anderem dann, wenn der Pilz weiterhin nachgewiesen werden kann, Surrogatparameter (wie
Dann sollte die Diagnostik zunächst darauf fokussieren, festzustellen, ob eine adäquate Fokussanierung stattgefunden hat und das richtige Antimykotikum ausreichend lange verabreicht wurde. Parameter wie der Wirkspiegel am Fokus und eine eventuelle Immunsuppression des Patienten sind zu berücksichtigen. Zu beachten ist auch, dass der ICU-Patient multiple pharmakokinetische Veränderungen aufgrund eines entweder erhöhten oder reduzierten Herzzeitvolumens und verschiedener Grade des Organversagens (Nieren, Leber) aufweist [38].
Eine Erweiterung der Blutkultur (BK)-Diagnostik kann die „dritte BK-Flasche“ darstellen, die ein spezielles Medium zur Anzucht von Pilzen enthält, aber nur bei bestimmten Blutkultur-Systemen inkludiert ist [39, 40, 41].
Therapeutisches Drug-Monitoring ist häufig erforderlich (s. Punkt 7). Wenn eine
frühe, adäquate antimykotische Therapie (innerhalb von 24 h) und eine Fokussanierung
(innerhalb von 48 h) gelangen, betrug in einer Studie die Letalität einer Candidämie mit septischem
Schock
3.3 Transplantation
Wichtige Pathogene bei Patienten nach Transplantation (TX) eines soliden Organs (SOT) sind Candida, Aspergillen und seltener Mucorales [43]. Die Wahrscheinlichkeit für bestimmte fungale Erreger hängt auch von der Art des transplantierten Organs ab [44]. In den meisten Fällen führen Candida-Spezies, bei der Lunge sind hingegen Aspergillen am häufigsten [45].
Die lokale Epidemiologie ist zu berücksichtigen. Bisher seltene Erreger werden zunehmend häufiger
gesehen. Die Bedeutung der Anamnese und der klinischen Untersuchung sollte nicht unterschätzt werden, da
sich daraus wertvolle Hinweise auf das mögliche Erregerspektrum gewinnen lassen (Freizeitvorlieben,
Haustiere, Urlaubsreisen
Zu den diagnostischen Möglichkeiten siehe auch Abbildung 2. Generell ist jede verfügbare diagnostische Möglichkeit auszuschöpfen [46].
4. Zweitlinientherapie
Derzeit stehen vier Substanzklassen systemisch wirksamer Antimykotika zur Behandlung systemischer Pilzinfektionen zur Verfügung: Polyene, Azole, Echinocandine und das Pyrimidinanalogon Flucytosin.
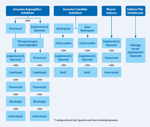
Die Differenzialtherapie der invasiven Pilzinfektion orientiert sich an der nachgewiesenen oder vermuteten Pilzspezies und an der klinischen Manifestation. Eine orientierende Therapie bei invasiven Pilzinfektionen ist in der Abbildung 3 dargestellt. Detaillierte Empfehlungen und Evidenzstärken sind in den spezifischen Leitlinien enthalten.
|
Abbildung 3: Therapeutische Möglichkeiten bei invasiven Pilzinfektionen
Click on the figure icon to see higher resolution |
4.1 Hämatoonkologie
Findet sich unter laufender systemischer Antimykotikatherapie eine positive Blutkultur mit einem Hefepilz, kann das Isolat in vitro empfindlich auf die laufende Therapie sein. Dann würde man mögliche Fremdkörper entfernen, ggf. den Medikamentenspiegel kontrollieren (Vori- und Posaconazol) und – falls dieser zu niedrig ist – die Dosis adaptieren. Ist das Isolat unbekannt bzw. der Spiegel im therapeutischen Bereich, ist es empfehlenswert, auf eine andere Antimykotikaklasse umzustellen [47].
Bei Lungeninfiltraten kann es ‐ je nach Vortherapie – sinnvoll sein, auf ein anderes Azol oder aber auf liposomales Amphotericin B umzustellen [47].
Es muss jedoch festgehalten werden, dass es derzeit für hämatologische Patienten, die unter voll dosierter Azol-, Echinocandin- oder Amphotericin-B-Therapie eine bIFI erleiden, keine evidenzbasierte Empfehlung für die Modifikation der antimykotischen Behandlung gibt.
4.2 Intensivmedizin
Die sogenannte Rescue-Therapie umfasst entweder den Wechsel der Substanzklasse, die Eskalation innerhalb der
verwendeten Antimykotikaklasse (
Bei einer invasiven Aspergillus-Infektion besteht die Erstlinientherapie aus Voriconazol [48]. Im Fall eines Therapieversagens sollte ein Wechsel auf liposomales Amphotericin B erfolgen. Resistenztestungen gewinnen hier immer mehr an Bedeutung und sind bei der Umstellung der Therapie bei vermutetem Therapieversagen zu beachten. Posaconazol stellt eine weitere Alternative dar, auch wenn bisher noch keine Daten aus einer vergleichenden Therapiestudie bei invasiver Aspergillose vorliegen. In Zukunft wird möglicherweise die Immuntherapie eine zusätzliche therapeutische Option bieten [49].
4.3 Transplantation
Für die Wahl eines geeigneten Antimykotikums sind die nachgewiesene Erregerspezies, der Schweregrad
der Erkrankung, das individuelle Risiko des Patienten, seine Organfunktionen (insbesondere Leber und Nieren),
Arzneimittelunverträglichkeiten und ‑interaktionen, die Vorbehandlungen mit Antimykotika sowie
die lokale Resistenzsituation von Bedeutung. Zur Therapie invasiver Mykosen geben
Grundsätzlich haben alle Substanzen eine gute und breite Wirksamkeit gegen Candida-Arten,
insbesondere Candida albicans. Einige Nicht-Candida-albicans-Spezies weisen Besonderheiten
bezüglich ihrer antimikrobiellen Empfindlichkeit auf, die bei der Substanzauswahl zu berücksichtigen
sind: So ist C. krusei resistent gegenüber Fluconazol, und etwa
Die Therapie von seltenen Pilzen (
4.4 Pädiatrische Aspekte
Durchbruchinfektionen bei Kindern mit malignen Erkrankungen können bei ausgeprägter Abwehrschwäche durch ansonsten sensible Pilzisolate ausgelöst werden. Daneben sind aber auch Infektionen durch primär resistente, seltene Pilzspezies oder auch durch azolresistenten Aspergillus fumigatus möglich. Die Beurteilung des Therapieansprechens und der Notwendigkeit einer Therapieumstellung ist bei ausgeprägter Abwehrschwäche schwierig und komplex, insbesondere bei persistierend neutropenischen Patienten.
Eine jüngere Studie aus Taiwan zeigte, dass Durchbruch-Candidämien bei pädiatrischen Patienten dort
zum größten Teil (fast
Zusammenfassend kann zur Zweitlinientherapie gesagt werden:
- Ein Versagen einer antimykotischen Therapie ist nicht selten (bis zu
30 % ). - Das Fortschreiten einer Grunderkrankung und die mangelnde Erholung aus einer Phase der Immunschwäche begünstigen das Ausbleiben des Behandlungserfolges.
- Mangelnde Fokussanierung und die Ausbildung von Biofilmen machen eine effektive Behandlung von Candida-Infektionen schwierig, auch wenn mikrobiologische Testungen einen therapeutischen Effekt vorhersagen.
- Hinzu kommen Infektfoci, bei denen die Grenzen zwischen Kolonisierung, unzureichender Sanierung und Therapieversagen fließend und die daher nur schwer voneinander abzugrenzen sind.
- Intrinsische Resistenzen, wie bei C. krusei, C. glabrata oder A. terreus, sollten bekannt sein und im Therapiekonzept beachtet werden.
- Echinocandine besitzen keine gute Wirksamkeit in tiefen Kompartimenten und sind deshalb
z. B. bei Augeninfektionen oder Meningitis nicht indiziert. - Azole sind, außer bei C. parapsilosis, nicht die Therapie der ersten Wahl bei einer Candidämie.
- Der Einsatz einer chirurgischen Intervention ist im Rahmen des Infektionsmanagements abzuklären.
5. Empfindlichkeitstests
Grundsätzlich (dies gilt für jeden Mikroorganismus) kann eine Resistenztestung zum Zweck der Surveillance oder zum Zweck der Therapieentscheidung durchgeführt werden. Dafür stehen klinische Breakpoints bzw. epidemiologische Cutoffs (ECOFF) zur Verfügung.
In die Festlegung der klinischen Breakpoints fließen mikrobiologische In-vitro-Daten, pharmakodynamische und ‑kinetische Parameter sowie Ergebnisse aus klinischen Studien ein. Wildtypen sind Mikroorganismen ohne erworbene Resistenzmechanismen oder Mutationen und liegen innerhalb des ECOFF; beide Werte (klinischer Breakpoint und ECOFF) sind speziesabhängig.
5.1 Hefepilze
Im Wesentlichen sind sich alle Leitlinien einig, dass sämtliche Candida-Isolate aus Blut sowie tiefen Infektionsorten (bzw. „klinisch relevante Isolate“) auf Resistenzen getestet werden sollten. In der IDSA-Leitlinie wird ausdrücklich festgestellt, dass alle klinisch relevanten Candida-Isolate gegen Azole getestet werden sollen. Eine Testung gegen Echinocandine sollte dann erfolgen, wenn eine Vortherapie mit einem Echinocandin bekannt ist oder es sich um C. glabrata oder parapsilosis handelt [50].
In der Praxis wird in den meisten Labors, die nicht nationale Referenzlabors sind, nicht die Mikrodilutionsmethode nach EUCAST, sondern ein kommerziell erhältliches Verfahren eingesetzt, wobei für Amphotericin B sowie Azole die Übereinstimmung sehr gut ist [58].
Komplexer ist die Situation bei den Echinocandinen. Wegen der hohen Abweichung zwischen verschiedenen Testlabors wurden von der EUCAST keine klinischen Breakpoints für Caspofungin definiert. Es ist aber bekannt, dass Mutationen im Zielgen FKS zu Kreuzresistenz gegen alle Echinocandine führen. Daher sind Isolate, die auf Anidulafungin / Micafungin empfindlich sind, auch auf Caspofungin empfindlich (möglicherweise gibt es jedoch Ausnahmen).
Zusätzlich zu FKS existieren jedoch auch Single-Nukleotid-Polymorphismen, die ebenfalls Resistenzeigenschaften verursachen können.
5.2 Schimmelpilze
Die Resistenztestung ist bei Schimmelpilzen im Vergleich zu Candida noch komplexer, da die MHK-Werte von Methode zu Methode unterschiedlich sind. Ein weiteres Problem besteht im Fehlen klinischer Breakpoints; es gibt lediglich (speziesspezifische) ECOFF-Werte.
Aus diesem Grund ist vor jeglicher Resistenztestung die Speziesdiagnose anzustreben, da diese bereits Rückschlüsse auf das biologische Verhalten des Pilzes zulässt.
In der Praxis relativ gut ablesbar ist die Resistenz von Schimmelpilzen gegen Amphotericin B. Aspergillus terreus ist unter Amphotericin B relativ konsistent mit schlechtem Therapieansprechen assoziiert [59, 60, 61, 62]. Resistenztestungen von Mucorales mittels Etest sind relativ schwer abzulesen [63].
Zunehmende klinische Relevanz haben Azol-Resistenzen von Aspergillus fumigatus. Diese treten signifikant häufiger bei hämatoonkologischen Patienten auf, und zwar auch ohne vorherige Azolexposition des Patienten [64, 65].
Das heißt, dass die antimykotische Resistenztestung von Schimmelpilzen derzeit dazu dient, Wildtypen von Nicht-Wildtypen zu unterscheiden; dies funktioniert am besten für Amphotericin B und Azole. Nicht-Wildtypen werden eher mit schlechtem Ansprechen bzw. Therapieversagen assoziiert. Für die Echinocandine sind hierzu weniger Informationen vorhanden. Resistenztests bei Schimmelpilzen sollten nur in spezialisierten bzw. Referenzlabors durchgeführt werden.
6. Resistenzraten von Pilzen
Zunächst ist zwischen sogenannter intrinsischer oder natürlicher Resistenz einerseits und erworbener Resistenz andererseits zu unterscheiden.
Beispiele für intrinsische Resistenz sind etwa die Fluconazol-Resistenz von Candida krusei oder die (allerdings nicht immer vorhandene) Resistenz von Aspergillus lentulus gegen Itraconazol, Voriconazol und Amphotericin B [66].
Erworbene Resistenzen sind weitgehend therapieabhängig (können aber
Candida albicans ist in Österreich nach wie vor die häufigste Candida-Spezies
(
Auch in GERMAP 2015 finden sich insgesamt gegen Candida sehr niedrige Resistenzraten, mit Ausnahme
von C. glabrata, die zu
Trotz dieser ermutigenden Daten nehmen
Schimmelpilze wurden für Österreich zuletzt im AURES-Bericht 2014 erfasst – insgesamt 204 Isolate,
vor allem aus Pulmologie (
Die Fusarium-Isolate waren zu
In Deutschland fand sich bei
7. Therapeutisches Drug-Monitoring
Ein therapeutisches Drug-Monitoring (TDM) lässt sich für Fluconazol in der Praxis meist vermeiden, indem
man schon empirisch höhere Dosen (
Für Posaconazol wird für die Prophylaxe ein Talspiegel
Was Isavuconazol betrifft, so liegt insofern eine unbefriedigende Situation vor als in der SECURE-Studie [72] (Vergleich mit Voriconazol) nur Talspiegel für Isavuconazol, nicht aber für Voriconazol publiziert wurden und in der Fachinformation zu lesen ist, dass es keinen Zusammenhang zwischen Isavuconazol-Plasmaspiegeln und Wirksamkeit gebe [73]. In ECIL-6 wird dennoch gefordert, TDM für Voriconazol oder Isavuconazol zumindest bei therapieresistenten oder Durchbruchinfektionen, bei Pathogenen mit herabgesetzter Empfindlichkeit sowie bei Medikamenteninteraktionen durchzuführen [26].
Für ein TDM bei Echinocandinen gibt es derzeit keine Empfehlungen.
Interessenkonflikte
Dieses Projekt wurde durch eine Kooperation mit Gilead Sciences GesmbH, Wien, finanziert. Der gesamte Betrag wurde für die Umsetzung des Projektes verwendet, weder die Autoren noch die ÖGIT haben damit Geld verdient.
- Cornelia Lass-Flörl: Forschungs-Grants, Reise-Grants oder Vortragshonorare von Astellas, Gilead Sciences, Pfizer, Schering Plough, MSD und Basilea.
- Florian Thalhammer: Sponsoring von Fortbildungsveranstaltungen, unrestricted Grants für Forschungsvorhaben, Honorare für Advisory Board Meetings bzw. Vortragshonorare, Reiseunterstützung (2013 – 2016): AbbVie, Actavis, Angelini, Astellas, AstraZeneca, Basilea, MSD, Montavit, Novartis, Pfizer, Sandoz, Trommsdorf.
- Dieter Buchheidt: Mitglied von Advisory Boards: Basilea, Gilead und MSD; Forschungsmittel von Gilead und Pfizer; Honorare für Vorträge: Astellas, Gilead, MSD, Pfizer und TEVA; Reisekostenunterstützungen: Astellas, Gilead, Jazz Pharmaceuticals, MSD und Pfizer.
- Andreas Groll: Grants: Gilead, MSD & Pfizer; Mitglied von Advisory Boards: Astellas, Basilea, Gilead, MSD und Schering-Plough; Honorare für Vorträge: Astellas, Basilea, Gilead, MSD, Pfizer, Schering-Plough und Zeneus / Cephalon.
- Rainer Höhl: Astellas, AstraZeneca, Basilea, Gilead, MSD, Pfizer,
Thermo Fisher . - Robert Krause: Beratertätigkeit bei Cubist, MSD, Rokitan, Basilea und Gilead.
- Oliver Kurzai: Mitglied von Advisory Boards: Basilea; Honorare für Vorträge: Astellas, Basilea, Pfizer.
- Georg Maschmeyer: Honorare für Beratungen: Gilead, Pfizer, F2G. Honorare für Vortragstätigkeiten: Gilead, Pfizer, Merck-Serono, Celgene, Basilea, Janssen-Cilag. Sponsoring von Kongressteilnahmen mit Gegenleistung: Roche, Pfizer, AMGEN, Merck-Serono.
- Andrew Ullmann: Employment or Leadership Position: None. Advisory Role: Basilea, Boehringer Ingelheim, Pfizer, MSD, Astellas, Gilead, Aicuris. Stock Ownership: None. Honoraria: Astellas, Basilea, Gilead, MSD, Astellas, and Pfizer. Financing of Scientific Research: Astellas, Gilead, MSD, Astellas, Pfizer, and BioCryst. Expert Testimony: Astellas. Other Financial Relationships: None.
- Markus Weigand: Vortragshonorare: Astellas Pharma, AstraZeneca,
B. Braun , Biosyn, CLS Behring, Cytosorb, Eli Lilly, GE-Healthcare, Gilead, Glaxo Smith Kline, Janssen, Köhler Chemie, Merck Sharp & Dohme, Novartis, Orion, Pfizer Pharma. Astellas Pharma. Advisory Boards:B. Braun , Gilead, Merck Sharp & Dohme, Pall Medical, Pfizer Pharma. - Birgit Willinger: Advisory Boards: Basilea, MSD. Grants: Pfizer. Honorare für Vorträge: Astellas, Basilea, BioMerieux, Gilead, MSD, Pfizer. Reieskostenunterstützung: Astellas.
Literatur
-
Micafungin versus liposomal amphotericin B for candidaemia and invasive candidosis:
a phase III randomised double-blind trial.
Lancet,
2007; 369(9572):1519–1527.


-
Comparison of caspofungin and amphotericin B for invasive candidiasis.
N Engl J Med,
2002; 347(25):2020–2029.


-
Liposomal amphotericin B as initial therapy for invasive mold infection: a randomized
trial comparing a high-loading dose regimen with standard dosing (AmBiLoad trial).
Clin Infect Dis,
2007; 44(10):1289–1297.


-
Outcome predictors of 84 patients with hematologic malignancies and Fusarium infection.
Cancer,
2003; 98(2):315–319.


-
Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis.
N Eng J Med,
2002; 347(6):408–415.


-
Strategien bei Versagen einer antimykotischen Therapie auf Intensivstation [Strategies for
antifungal treatment failure in intensive care units].
Anaesthesist,
2015; 64(9):643–658.


-
Defining responses to therapy and study outcomes in clinical trials of invasive fungal diseases:
Mycoses Study Group and European Organization for Research and Treatment of Cancer Consensus
Criteria.
Clin Infect Dis , 2008; 47(5):674–683.

-
Increasing volume and changing characteristics of invasive pulmonary aspergillosis on sequential
thoracic computed tomography scans in patients with neutropenia.
J Clin Oncol , 2001; 19(1):253–259.

-
Treatment of invasive aspergillosis with posaconazole in patients who are refractory to or
intolerant of conventional therapy: an externally controlled trial.
Clin Infect Dis , 2007; 44(1):2–12.

-
Efficacy and safety of caspofungin for treatment of invasive aspergillosis in patients refractory
to or intolerant of conventional antifungal therapy.
Clin Infect Dis , 2004; 39(11):1563–1571.

-
Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease.
N Engl J Med,
2007; 356(4):335–347.


-
Randomized, double-blind trial of fluconazole versus voriconazole for prevention of invasive fungal
infection after allogeneic hematopoietic cell transplantation.
Blood,
2010; 116(24):5111–5118.


-
Breakthrough invasive fungal disease in patients receiving posaconazole primary prophylaxis:
a 4-year study. Clin Microbiol Infect, 2014; 20(11):O952–O959.

-
Invasive fungal breakthrough infections, fungal colonization and emergence of resistant strains in
high-risk patients receiving antifungal prophylaxis with posaconazole: real-life data from a
single-centre institutional retrospective observational study.
J Antimicrob Chemother,
2012; 67(9):2268–2273.


-
A cohort study on breakthrough invasive fungal infections in high-risk patients receiving antifungal prophylaxis.
J Antimicrob Chemother,
2016; 71(9):2634–2641.


-
Breakthrough invasive fungal diseases during voriconazole treatment for aspergillosis:
A 5-year retrospective cohort study.Med Mycol , 2017; 55(3):237–245.

-
Serum posaconazole levels during acute myeloid leukaemia induction therapy: correlations with
breakthrough invasive fungal infections.
Mycoses,
2015; 58(6):362–367.


-
Issues related to the design and interpretation of clinical trials of salvage therapy for invasive
mold infection.
Clin Infect Dis, 2006; 43(11):1449–1455.

-
Earlier response assessment in invasive aspergillosis based on the kinetics of serum Aspergillus
galactomannan: proposal for a new definition.
J Infect Dis , 2011; 53(7):671–676.

-
When primary antifungal therapy fails.
Clin Infect Dis , 2008; 46(9):1426–1433.

-
Salvage therapy for aspergillosis.
Clin Infect Dis , 2005; 41(Suppl. 6):S387–S388.

-
Prospective evaluation of clinical and biological markers to predict the outcome of invasive
pulmonary aspergillosis in hematological patients.
J Clin Microbiol, 2012; 50(3):823–830.

-
Galactomannan serves as a surrogate endpoint for outcome of pulmonary invasive aspergillosis in
neutropenic hematology patients.
Cancer,
2009; 115(2):355–362.


-
Prognostic features of galactomannan antigenemia in galactomannan-positive invasive aspergillosis.
J Clin Microbiol, 2010; 48(4):1255–1260.

-
Serial assessment of pulmonary lesion volume by computed tomography allows survival prediction in
invasive pulmonary aspergillosis.
Eur Radiol , 2017; 27(8):3275–3282.

-
Triazole antifungal therapeutic drug monitoring.
https://www.ebmt.org/Contents/Resources/Library/ECIL/Documents/2015%20ECIL6/ECIL6-Triazole-TDM-07-12-2015-Lewis-R-et-al.pdf

-
Treatment of invasive fungal infections in cancer patients-updated recommendations of the Infectious
Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO).
Ann Hematol , 2014; 93(1):13–32.

-
Micafungin (FK463), alone or in combination with other systemic antifungal agents, for the treatment
of acute invasive aspergillosis.
J Infect , 2006; 53(5):337–349.

-
Multicenter, noncomparative study of caspofungin in combination with other antifungals as salvage
therapy in adults with invasive aspergillosis.
Cancer,
2006; 107(12):2888–2897.


-
Efficacy and safety of voriconazole in the treatment of acute invasive aspergillosis.
Clin Infect Dis , 2002; 34(5):563–571.

-
Salvage therapy with caspofungin for invasive aspergillosis: results from the caspofungin
compassionate use study.
J Infect , 2005; 50(3):196–205.

-
Epidemiology of invasive aspergillosis and azole resistance in patients with acute leukaemia: the
SEPIA Study.
Int J Antimicrob Agents, 2017; 49(2):218–223.

-
Mucormycosis after allogeneic haematopoietic stem cell transplantation: a French Multicentre
Cohort Study (2003–2008).
Clin Microbiol Infect , 2012; 18(10):E396–E400.

-
Epidemiology and outcomes of invasive fungal infections in allogeneic haematopoietic stem cell
transplant recipients in the era of antifungal prophylaxis: a single-centre study with focus
on emerging pathogens.
Mycoses,
2015; 58(6):325–326.


-
Intensive care unit patients with candidaemia.
ECCMID, Copenhagen 2015. EP075.
https://www.escmid.org/escmid_publications/escmid_elibrary/material/?mid=25427

-
ICU-acquired candidaemia in France: Epidemiology and temporal trends, 2004–2013 –
A–study from the REA-RAISIN network.
J Infect , 2017; 75(1):59–67.

-
No increase in primary nosocomial candidemia in 682 German intensive care units during 2006 to
2011.
Euro Surveill , 2013; 18(24): pii:20505. http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20505
-
Pharmacokinetic variability and exposures of fluconazole, anidulafungin, and caspofungin in
intensive care unit patients: Data from multinational Defining Antibiotic Levels in Intensive care
unit (DALI) patients Study.
Crit Care , 2015; 19:33.

-
ESCMID* guideline for the diagnosis and management of Candida diseases 2012: diagnostic procedures.
Clin Microbiol Infect , 2012; 18(Suppl. 9):9–18.

-
A research agenda on the management of intraabdominal candidiasis: results from a consensus of
multinational experts.
Intensive
Care Med , 2013; 39(12):2092–2106.

-
S1-Leitlinie 082-005: Diagnose und Therapie von Candida Infektionen. Gemeinsame Empfehlungen
der Deutschsprachigen Mykologischen Gesellschaft (DMYKG) und der Paul-Ehrlich-Gesellschaft für
Chemotherapie (PEG). ICD?10:?B37.-
, http://www.awmf.org/leitlinien/detail/ll/082-005.html 
-
A multicenter study of septic shock due to candidemia: outcomes and predictors of mortality.
Intensive Care Med , 2014; 40(6):839–845.

-
Infection in solid-organ transplant recipients.
N Engl J Med , 2007; 357(5):2601–2614.

-
Invasive fungal infections among organ transplant recipients: results of the Transplant-Associated
Infection Surveillance Network (TRANSNET).
Clin Infect Dis , 2010; 50(8):1101–1111.

-
Host-dependent patterns of tissue injury in invasive pulmonary aspergillosis.
Am J Clin Pathol, 2007; 127(3):349–355.

-
Molecular and nonmolecular diagnostic methods for invasive fungal infections.
Clin Microbiol Rev , 2014; 27(3):490–526.

-
Our 2014 approach to breakthrough invasive fungal infections.
Mycoses,
2014; 57(11):645–651.


-
Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious
Diseases Society of America.
Clin Infect Dis , 2016; 63(4):e1–e60.

-
Immunotherapy: a potential adjunctive treatment for fungal infection.
Curr Opin Infect Dis,
2014; 27(6):511–506.


-
Clinical practice guideline for the management of candidiasis: 2016 update by the Infectious
Diseases Society of America.
Clin Infect Dis , 2016; 62(4):e1–e50.

-
Aspergillosis in solid organ transplantation.
Am J Transplant , 2013; 13(Suppl. 4):228–241.

-
Candida infections in solid organ transplantation.
Am J Transplant , 2013; 13(Suppl. 4):220–227.

-
Breakthrough candidemia in children: clinical and microbiological characteristics, therapeutic
strategies and impact on outcomes.
Future Microbiol,
2017; 12:695–705.


-
Candida lusitaniae infections in the era of fluconazole availability.
Clin Infect Dis , 2003; 36(2):e14–e18.

-
Candida lusitaniae: a cause of breakthrough fungemia in cancer patients.
Clin Infect Dis , 2001; 32(2):186–190.

-
Candida lusitaniae MICs to the echinocandins are elevated but FKS-mediated resistance
is rare.
Diagn Microbiol Infect Dis,
2016; 84(1):52–54.


-
Triazole fungicides can induce cross-resistance to medical triazoles in Aspergillus fumigatus.
PLoS One , 2012; 7(3):e31801.

-
Comparison of the Vitek 2 antifungal susceptibility system with the clinical and laboratory
standards institute (CLSI) and European Committee on Antimicrobial Susceptibility Testing (EUCAST)
broth microdilution reference methods and with the Sensititre YeastOne and Etest techniques for
in vitro detection of antifungal resistance in yeast isolates.
J Clin Microbiol , 2010; 48(5):1782–1786.

-
Patterns of susceptibility of Aspergillus isolates recovered from patients enrolled in the
Transplant-Associated Infection Surveillance Network.
J Clin Microbiol , 2009; 47(10):3271–3275.

-
In-vitro testing of susceptibility to amphotericin B is a reliable predictor of clinical
outcome in invasive aspergillosis.
J Antimicrob Chemother, 1988; 42(4):497–502.

-
In vitro analyses, animal models, and 60 clinical cases of invasive Aspergillus terreus infection.
Antimicrob Agents Chemother,
2004; 48(9):3217–3225.


-
In vitro activities of posaconazole, itraconazole, voriconazole, amphotericin B, and
fluconazole against 37 clinical isolates of zygomycetes.
Antimicrob Agents Chemother,
2002; 46(5):1581–1582.


-
Etest cannot be recommended for in vitro susceptibility testing of mucorales.
Antimicrob Agents Chemother,
2015; 59(6):3663–3665.


-
Clinical implications of azole resistance in Aspergillus fumigatus, The Netherlands,
2007–2009.
Emerg Infect Dis , 2011; 17(10):1846–1854.

-
Azole resistance in Aspergillus: a growing public health menace.
Future Microbiol,
2011; 6(11):1229–1232.


-
Laboratory diagnosis of invasive aspergillosis: from diagnosis to prediction of outcome.
Scientifica (Cairo),
2013; 2013:459405.


-
AURES: Resistenzberichte Österreich: AURES-Bericht 2015.
https://www.ages.at/themen/ages-schwerpunkte/antibiotika-resistenzen/resistenzberichte/

-
Antibiotikaverbrauch und die Verbreitung von Antibiotikaresistenzen in der Human- und
Veterinärmedizin in Deutschland.
http://www.p-e-g.org/econtext/germap

-
Increasing echinocandin resistance in Candida glabrata: clinical failure correlates with
presence of FKS mutations and elevated minimum inhibitory concentrations.
Clin Infect Dis , 2013; 56(12):1724–1732.

-
Candida spp. with acquired echinocandin resistance, France, 2004–2010.
Emerg Infect Dis , 2012; 18(1):86–90.

-
AURES: Resistenzberichte Österreich: AURES-Bericht 2014.
https://www.ages.at/themen/ages-schwerpunkte/antibiotika-resistenzen/resistenzberichte/

-
Isavuconazole versus voriconazole for primary treatment of invasive mould disease caused by
Aspergillus and other filamentous fungi (SECURE):
a phase 3 , randomised-controlled, non-inferiority trial. Lancet, 2016; 387(10020):760–769.

- Fachinformation Cresemba®. Stand der Information: Februar 2016.

|
|
published online:
|
| english abstract |